The origin of BMK TOOLS®
Born from the advancement of knowledge about molecular genetics and the extraordinary technological progress (bioinformatics, sequencing, data management), personalised medicine has established itself over the last decade as the solution to better treat diseases, better diagnose them, better predict their appearance and improve their prevention. The rise of personalised medicine is only possible if practitioners have access to biomarkers and diagnostic tests to define patient populations that are more likely to respond to a treatment. Furthermore, the pharmaceutical industries have seen the costs of developing a drug soar and the use of relevant biomarkers (efficacy, toxicity) during the research and development stages has become vital. This places biomarkers at the centre of attention. However, their development and their use in the practice of medicine are not that easy.
Biomarker development takes place within a complex ecosystem, with many stakeholders (researchers, pharmaceutical industries, diagnostic industries, clinicians, regulatory authorities), all of whom have different objectives and requirements. Given the complexity of the biomarker development process, the market players need to work together (joint projects, sharing expertise…) and a relationship of trust is therefore necessary in the long term. In this context, one of the objectives of the Consortium for Thematic Valorisation (CTV) within Aviesan is to valorise research in France by facilitating contacts, exchanges, and implementing projects combining the academic world and the business community. BMK TOOLS® was therefore created to meet the need to coordinate and structure the “biomarkers” sector. Since the interest in the development of relevant biomarkers which lead to better care for patients goes beyond the national framework, EIT Health (branch of EIT, European Institute for Innovation and Technology, a body of the European Commission), joins BMK TOOLS® for the future dissemination of this tool in Europe.
Download
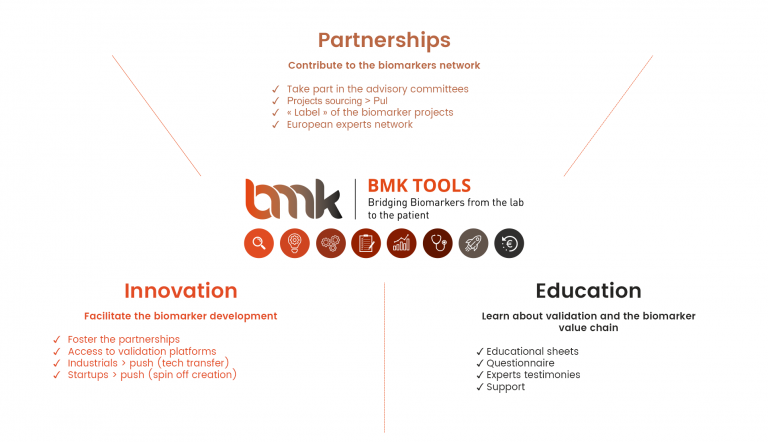
BMK TOOLS® includes:
> An educational module “Learn” in which information fact sheets explaining every step of the value chain of biomarkers and various information is available
> An application module “Position a project” in which an online questionnaire is made available to position your biomarker projects in the value chain and to ask for support
Le développement d’un médicament
Les médicaments sont des produits particulièrement sophistiqués, qui doivent apporter un bénéfice tangible aux patients (augmentation de la durée de vie, amélioration de la qualité de vie…), tout en limitant les risques (toxicité, effets secondaires). Développer des médicaments est de fait un processus long et complexe qui s’articule autour de trois grandes étapes : la recherche, les essais précliniques et le développement clinique et pharmaceutique. Malgré d’importants efforts d’investissement et l’apport des nouvelles technologies (transcriptomique, génomique, protéomique, métabolomique…), l’industrie pharmaceutique rencontre de nombreuses difficultés pour mettre sur le marché de nouveaux médicaments. En effet, le nombre de médicaments obtenant une AMM (Autorisation de Mise sur le Marché) décroît alors que le nombre de molécules soumises aux instances réglementaires reste constant (1). Sur 10000 molécules criblées, 10 font l’objet d’un dépôt de brevet puis une seule arrivera finalement à passer toutes les étapes de tests et d’essais cliniques. La durée du développement d’un médicament, ainsi que son coût sont deux facteurs qui expliquent cette attrition : il faut en moyenne 14 ans et entre 1.8 et 2.9 milliards de dollars d’investissement entre la découverte d’une molécule et sa mise sur le marché (2). D’autres problèmes majeurs freinent le développement de nouveaux médicaments : le faible pouvoir prédictif de certains modèles animaux, l’apparition de toxicités chez l’homme, ou encore l’insuffisance d’efficacité clinique sur la population considérée. Selon certaines études, près de la moitié des patients ne répondent pas au traitement qui leur est proposé : par exemple 38% des patients dépressifs ou encore 50% des patients souffrant d’arthrite (3).
Face à ce constat, le concept de médecine personnalisée « proposer le bon traitement, au bon moment pour un patient » s’est imposé depuis deux décennies. La médecine personnalisée, ou médecine de précision, est un domaine en plein essor, dans lequel les médecins s’appuient sur des tests diagnostiques pour déterminer quel traitement (ou thérapie ciblée) sera le plus efficace pour chaque patient. Les domaines de la thérapie ciblée et du diagnostic deviennent de plus en plus indissociables, d’où le terme de «théranostique» (contraction de « thérapeutique » et de « diagnostic »). Dans ce contexte, le test diagnostique utilisé pour identifier un biomarqueur est appelé « test compagnon ».
Les biomarqueurs sont devenus des outils incontournables dans la découverte de nouveaux médicaments et le développement de la médecine personnalisée, représentant un véritable enjeu stratégique pour les industries pharmaceutiques et les sociétés de biotechnologies (4). L’enjeu économique est également fort pour les autorités de santé car l’utilisation des biomarqueurs et la sélection des patients répondeurs à un traitement permettrait de limiter les coûts de santé.
- Schuhmacher et al, « Changing R&D models in research-based pharmaceutical companies », Journal of Translational Medicine, 2016
- DiMasi et al., « Innovation in the pharmaceutical industry: new estimates of R&D costs », J Health Economics, 2016
- Spear BB et al, « Clinical applications of pharmacogentics », TRENDS in Molecular Medicine, 2001
- Paul SM et al, « How to improve R&D productivity: The pharmaceutical industry’s grand challenge », Nature Reviews Drug Discovery, 2010
A propos des biomarqueurs
Un biomarqueur est défini comme « une caractéristique biologique mesurée de façon objective et évaluée comme un indicateur soit de processus biologiques, normaux ou pathologiques, soit de réponses pharmacologiques résultant d’une intervention thérapeutique ». Un biomarqueur peut donc être une molécule circulante, une mutation génétique etc… Ces caractéristiques biologiques peuvent être mesurée ex vivo, ou in vivo et peuvent aussi correspondre à un ensemble de caractéristiques physiologiques mesurées simultanément. Lorsqu’un test biomarqueur mesure un ensemble de paramètres en parallèle et non pas un seul paramètre, on parle de « test multiplexe ».
Le premier biomarqueur, développé par le laboratoire Roche, a été le gène HER2. En effet, avec l’introduction dans les années 1990 de l’Herceptin (ou trastuzumab, un anticorps anti-HER2), pour traiter le cancer du sein, Roche a démontré qu’il était possible d’anticiper la réponse au traitement, grâce à un simple test génétique sur les patientes. L’Herceptin agit seulement sur les cancers des femmes qui sur-expriment le gène HER2 (12 à 20% des patientes). Il a ainsi été le premier médicament autorisé issu de la médecine stratifiée : on disposait ainsi du traitement et du test compagnon correspondant. Roche a ainsi ouvert la voie à une pratique tendant à se généraliser, notamment ces cinq dernières années. Sur les 45 médicaments approuvés par la FDA en 2015, 13 étaient des médicaments issus de la médecine personnalisée, soit 28% des médicaments.
Les biomarqueurs sont devenus des outils incontournables dans la découverte de nouveaux médicaments et le développement de la médecine personnalisée, représentant un véritable enjeu stratégique pour les industries pharmaceutiques et les sociétés de biotechnologies 1. L’enjeu économique est également fort pour les autorités de santé car l’utilisation des biomarqueurs et la sélection des patients répondeurs à un traitement permettrait de limiter les coûts de santé.
Selon leur utilisation, les biomarqueurs peuvent être classés en deux catégories 2 :
- au cours du développement des médicaments :
- biomarqueur mécanistique: permet de comprendre les mécanismes de la maladie
- biomarqueur pharmaco-génomique: permet l’étude des mécanismes génétiques et des variations individuelles de la réponse aux médicaments
- biomarqueur d’efficacité: reflète l’effet d’un traitement sur le patient
- biomarqueur de toxicité: rend compte de l’effet toxicologique du médicament
- au cours du suivi des patients
- biomarqueur de stade : permet de statuer sur les différents stades de la maladie
- biomarqueur diagnostique: permet d’identifier la présence d’une maladie/ refléter l’apparition d’un état pathologique
- de prédisposition : permet de prédire le risque pour une personne de développer une maladie au cours de sa vie.
- biomarqueur pronostique: permet de prédire l’évolution de la maladie
- biomarqueur compagnon : permet d’identifier, avant et/ou pendant le traitement, les patients les plus susceptibles de bénéficier du médicament en question; ou d’identifier, avant et/ou pendant le traitement, les patients susceptibles de présenter un risque accru d’effets indésirables graves en réaction au traitement par le médicament en question;
- surrogate endpoint(critère de substitution) : paramètre biologique qui se substitue à un critère d’efficacité clinique
L’intérêt de l’utilisation des biomarqueurs est double 1 :
1/ pendant le développement d’un médicament
- réduction de la durée et des coûts des essais cliniques
- Les biomarqueurs peuvent constituer des critères objectifs supplémentaires pour évaluer l’efficacité ou la toxicité du traitement (en plus des critères cliniques habituels), permettant une meilleure sélection des candidats médicaments.
- L’utilisation de biomarqueurs comme « surrogate endpoint », se substituant à un critère d’évaluation clinique nécessitant un suivi long et/ou couteux permet également de limiter la durée et le coût des essais cliniques.
- Sélectionner les patients pour lesquels le traitement en cours de développement représente un bénéfice et constitue ainsi des facteurs d’enrichissement de population.
2/ dans la pratique clinique
- Evaluation des risques : tests génétiques permettant de détecter des prédispositions à certaines maladies
- Prévention : suivi de patients à risque et proposition de traitement pour éviter le développement de maladies
- Détection plus précoce, au niveau moléculaire, des maladies
- Diagnostic plus précis permettant des stratégies de traitement personnalisés
- Traitements ciblés, plus efficaces, avec moins d’effets secondaires
- Suivi de la progression de la maladie et de la réponse au traitement
- Meilleure compliance au traitement (en limitant les effets secondaires)
Le développement d’un biomarqueur et sa mise sur le marché est, comme pour un médicament, un processus long et complexe. En effet, de nombreuses étapes de validation sont nécessaires mais extrêmement coûteuses. Ce développement peut être effectué dans une démarche prospective ou rétrospective. Dans le premier cas, le développement du test se fait en même temps que celui du médicament auquel il est associé. A l’opposé, le biomarqueur peut être développé après la thérapie qui lui est associée. En effet, l’analyse rétrospective de résultats d’un ou de plusieurs essais, réalisés sur une population de patients non sélectionnés par un marqueur peut mener à l’identification de nouveaux marqueurs. Le test sera développé a posteriori, sur la base de réponses au traitement lors des essais. Un essai prospectif pourra être conduit pour valider le test.
A l’instar du développement d’un médicament, une chaine de valeur spécifique pour les biomarqueurs (diagnostic compagnon) a été mise en place. Les étapes clés du développement sont :
- La découverte du biomarqueur
- La conception de l’essai de détection
- Le développement de l’essai (& software)
- La validation analytique
- La validation clinique
- L’aspect réglementaire, l’approbation et le lancement
- Le remboursement
Même si de nombreux biomarqueurs ont d’ores et déjà été identifiés, très peu atteignent le marché. Par exemple, en cancérologie, sur 1260 « candidats » biomarqueurs développés, seulement 9 sont allés jusqu’à la mise sur le marché. Selon Leem, seulement 3 à 5 % des biomarqueurs utilisés au cours du développement d’un nouveau médicament sont commercialisés. Les industries pharmaceutiques (Sanofi, Roche, Pfizer…), diagnostiques (Abbott, Roche, BioMerieux, BioRad…) et instrumentation (Illumina, Brücker, LifeTech…) sont en pleine mutation et les initiatives de coordination et de structuration auront des retombées positives tant pour la recherche académique que pour l’économie. En effet, même si tout le monde est convaincu que les biomarqueurs joueront un rôle essentiel, un certain nombre de verrous demeurent et ralentissent leur utilisation.
Parmi ces facteurs limitants, on peut retenir :
- la complexité des technologies destinées à les identifier et à les mesurer
- la difficulté de la validation scientifique et clinique du biomarqueur et de sa méthode d’identification et de mesure
- l’acceptation et l’utilisation du biomarqueur par les cliniciens (manque d’information, difficile à mettre en place en routine…)
Un bon biomarqueur compagnon doit en définitive rassembler cinq critères : fiabilité, précision, reproductibilité, sensibilité, spécificité et doit être meilleur que ce qui existe sur le marché pour être accepté et utilisé par les cliniciens.
- Paul SM et al, « How to improve R&D productivity: The pharmaceutical industry’s grand challenge », Nature Reviews Drug Discovery, 2010
- Afssaps : Cahier d’acteur : Les biomarqueurs, les produits de santé et l’Afssaps. 2011